Conhecimento que Transforma
a Segurança dos Alimentos!
Juntos, semeamos conhecimento para colher um futuro mais seguro
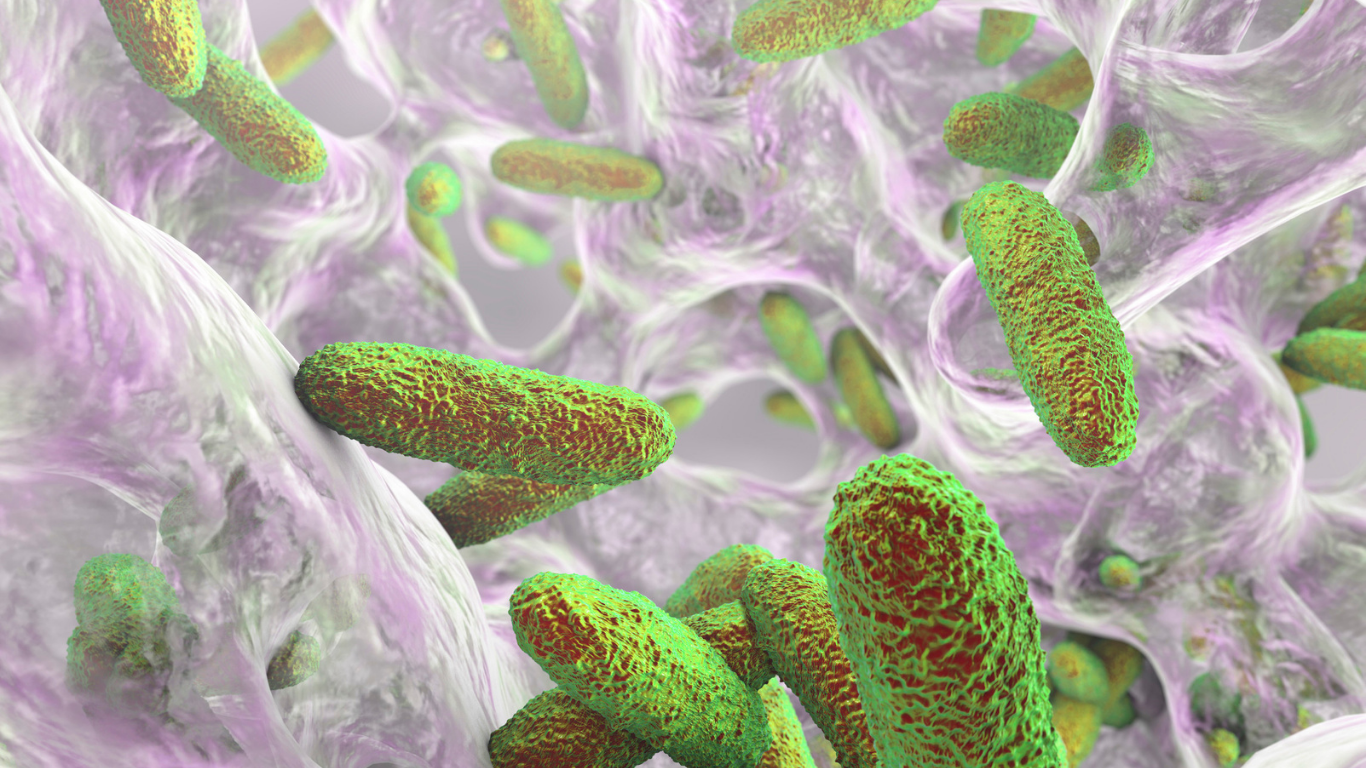
Biofilmes são comunidades microbianas organizadas, aderidas a superfícies, envoltas em uma matriz polimérica extracelular. Representam um dos maiores desafios no controle microbiológico em ambientes industriais, hospitalares e alimentícios.
O termo “biofilme” descreve agregados microbianos organizados que crescem sobre superfícies bióticas (com vida – exemplo: dentes) ou abióticas (sem vida – exemplo catéter ou superfícies de equipamentos), envoltos em uma matriz de substâncias poliméricas extracelulares (EPS). Esses biofilmes ocorrem naturalmente em ambientes aquáticos, solos, superfícies industriais e em tecidos humanos.
Segundo Jay et al. (2005), os biofilmes são extremamente importantes na microbiologia dos alimentos e representam risco significativo, pois protegem microrganismos contra agentes de limpeza e desinfecção, dificultando sua eliminação.
A formação do biofilme é um processo dinâmico e multifásico:
Adesão Inicial: Células planctônicas livres se aproximam da superfície e aderem de forma reversível. Fatores como carga da superfície, presença de proteínas adesinas e composição do substrato influenciam a adesão (Forsythe, 2010). Essa primeira adesão é mantida por interações físico-químicas não específicas constituindo o alicerce para o crescimento do biofilme.
Adesão Irreversível: Ocorre a transição do estágio reversível para o irreversível. Ocorre a produção da matriz extracelular que ancora firmemente as células à superfície. A EPS é composta por polissacarídeos, proteínas, lipídios e DNA extracelular (Doyle et al., 2012).
Maturação: Com o tempo, a estrutura se complexifica, formando microcolônias tridimensionais interconectadas por canais de água, que facilitam a difusão de nutrientes e remoção de resíduos (Jay et al., 2005).
Dispersão: As células do biofilme podem se desprender e colonizar novas superfícies, reiniciando o ciclo. Essa fase inicia quando o ambiente atual já não é mais tão favorável.
A matriz EPS (Substância Polimérica Extracelular) representa até 90% da biomassa do biofilme, desempenhando funções estruturais e protetoras. Ela atua como uma barreira contra agentes antimicrobianos, radiação UV e dessecação.
Além disso, a comunicação intercelular por quorum sensing regula genes envolvidos na formação de biofilme, produção de EPS e resistência a antimicrobianos (Forsythe, 2010).
Biofilmes são uma preocupação significativa na indústria de alimentos, onde microrganismos como Listeria monocytogenes, Salmonella spp., Escherichia coli e Pseudomonas spp. podem formar biofilmes em superfícies de aço inoxidável, plásticos e borrachas, mesmo após higienização (Doyle et al., 2012).
Esses biofilmes podem:
Jay et al. (2005) destacam que a Listeria monocytogenes pode sobreviver em biofilmes por semanas, mesmo sob refrigeração e após aplicação de sanitizantes convencionais.
Em ambientes hospitalares, biofilmes estão associados a infecções persistentes em cateteres, próteses e feridas crônicas. A resistência bacteriana em biofilmes pode ser até 1.000 vezes maior do que em células planctônicas (Doyle et al., 2012).
A presença de biofilmes em sistemas de abastecimento de água também representa risco à saúde, podendo abrigar patógenos como Legionella pneumophila.
A abordagem integrada, conhecida como Hurdle Technology, tem sido recomendada por autores como Forsythe (2010), combinando barreiras físicas, químicas e biológicas para dificultar a formação de biofilmes.
A nanotecnologia, engenharia de superfícies e uso de bacteriófagos têm se mostrado promissores na prevenção e remoção de biofilmes. Estudos genômicos também possibilitam o mapeamento de genes associados à adesão e resistência.
Biofilmes representam uma estratégia de sobrevivência microbiana altamente eficiente, com grande impacto na indústria de alimentos e na saúde humana. Sua resistência e complexidade exigem abordagens preventivas robustas, controle rigoroso de higienização e inovação constante em estratégias antimicrobianas.
Biofilmes: cidades invisíveis.
Referências
Jay, J. M. (2005). Microbiologia dos alimentos. 6th ed. Springer.
Forsythe, S. J. (2010). Microbiologia da Segurança dos Alimentos. Artmed.
Doyle, M. P.; Beuchat, L. R.; Montville, T. J. (2012). Food Microbiology: Fundamentals and Frontiers. 4th ed. ASM Press.
Sutherland, I. W. (2001). The biofilm matrix – an immobilized but dynamic microbial environment. Trends in Microbiology.
Costerton, J. W. et al. (1999). Bacterial biofilms: A common cause of persistent infections. Science, 284(5418).
Fonte da imagem: Canva.